Pre-mRNA剪接是转录后的一个过程,可由单个基因产生多个mRNA亚型。由于mRNA决定了蛋白质的序列和功能,剪接过程有可能扩大编码蛋白质的种类。Pre-mRNA的表达受转录调控,特定mRNA的相对丰度取决于剪接环境。RNA测序表明,超过90%的人类编码蛋白质的基因会通过pre-mRNA剪接去除内含子,内含子保留是一种常见的异常剪接类型。已有研究证明具有剪接功能的某些RNA结合蛋白(RBP)失调会促进癌症的发生和发展。
NONO,是一种非POU结构域的八聚体结合蛋白,属于DBHS蛋白家族。与许多RBP相似,NONO通过多种机制发挥其多种功能,参与不同的生理和病理过程。例如,NONO参与cGAS介导的先天免疫激活,在免疫通路中直接结合病毒衣壳,修复DNA损伤以及维持端粒稳态。此外,NONO在转录和转录后不同阶段的调控是至关重要的。NONO还协调代谢基因pre-mRNA的加工,尤其是内含子的去除。
然而,NONO的功能在RNA剪接和癌症的发生发展中还需要进一步的阐述,特别是在GBM中,这是迄今尚不明确的。癌细胞转录的过度激活导致需要处理的pre-mRNA增加,并且最近的研究报道了许多影响癌症进展的异常剪接事件。因此,剪接因子是未来癌症治疗的潜在治疗靶点,包括胶质母细胞瘤(GBM)的治疗。然而,在GBM中内含子剪接异常的保留机制尚不明确。
近期,山东大学李新钢和王剑教授的脑科学团队在Theranostics杂志上发表题为Targeting the splicing factor NONO inhibits GBM progression through GPX1 intron retention的文章,研究揭示了剪接因子NONO在GBM进展中的作用,以及靶向剪接因子来治疗GBM的可能性。
结果
01 剪接因子NONO在GBM中高表达
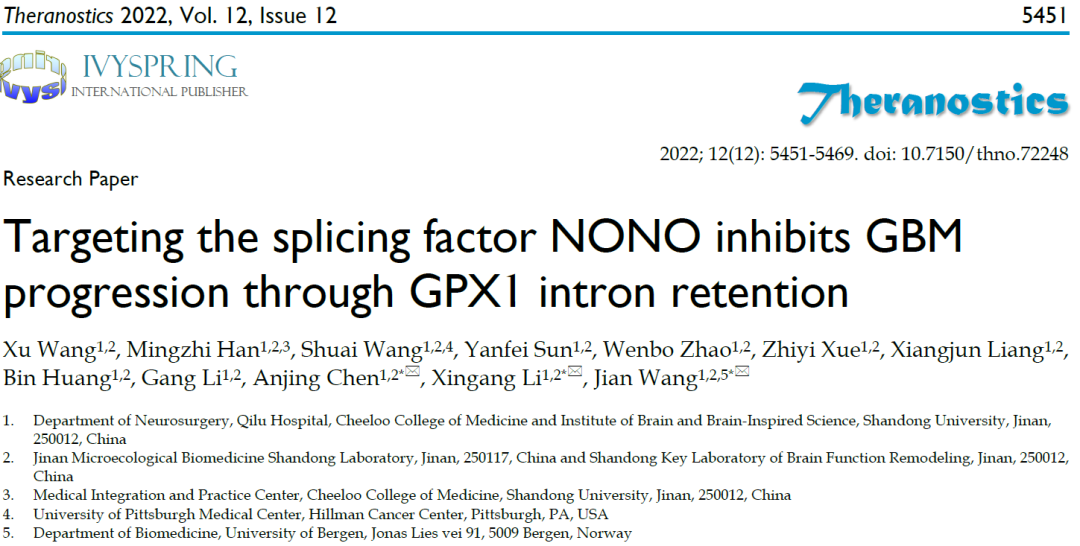
研究者通过公开的TCGA数据库,在具有mRNA剪接功能的355个蛋白中锁定治疗GBM的潜在靶点剪接因子NONO。NONO在GBM中表达显著高于正常脑组织,且其表达量与WHO肿瘤的分级相关。免疫荧光结果显示NONO的核定位与其剪接因子的作用相一致。综合分析表明NONO在GBM中高表达预示着预后较差(图1)。
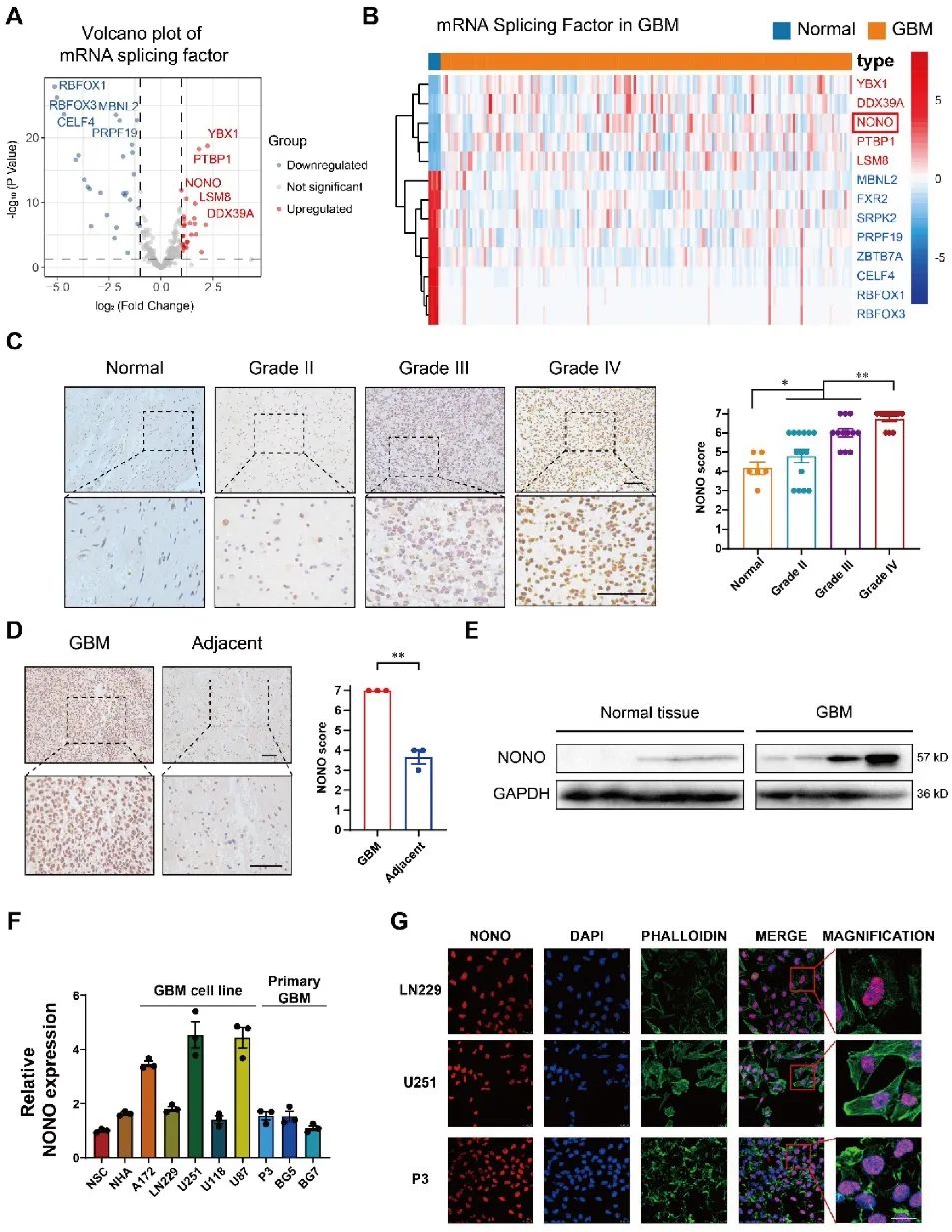
图1 剪接因子NONO在胶质瘤中表达上调并与肿瘤分级相关
02 剪接因子NONO影响GBM的生长
为了确定NONO在GBM发生中的潜在作用,研究人员通过siRNA和shRNA敲除细胞中的NONO。体外实验证明NONO的丢失会导致GBM细胞系(U251)和GBM患者来源的原代细胞(P3)增殖减少,迁移与侵袭能力降低,并且细胞发生凋亡。在小鼠体内原位异种移植U251-和P3-shNONO/NC细胞,经过观察发现,移植shNONO的细胞生长显著降低,细胞增殖减少,且荷瘤小鼠的总生存期得以延长。综上所述,NONO的缺失抑制脑胶质瘤增殖,促进细胞凋亡,进一步抑制了GBM侵袭和自我更新(图2)。
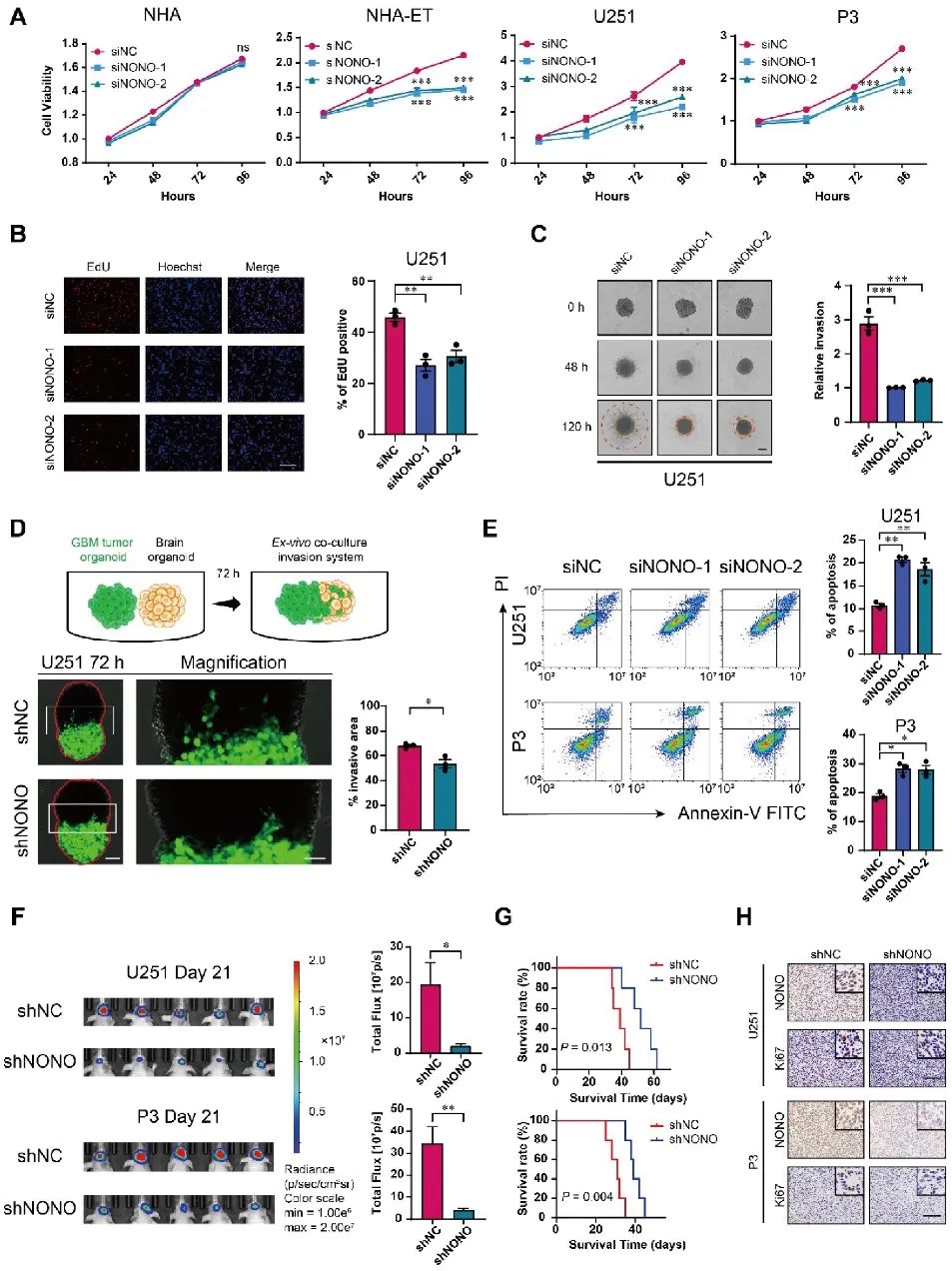
图2 敲除NONO可抑制GBM细胞系的增殖和侵袭,促进细胞凋亡
进一步利用慢病毒构建稳定过表达NONO的LN229和P3细胞。CCK8、EdU、克隆形成、迁移和侵袭等体外实验表明,NONO过表达促进LN229和P3细胞的生长和侵袭。此外,在体内过表达NONO促进LN229-和P3异种移植瘤的生长,并显著缩短小鼠的生存期(图3)。
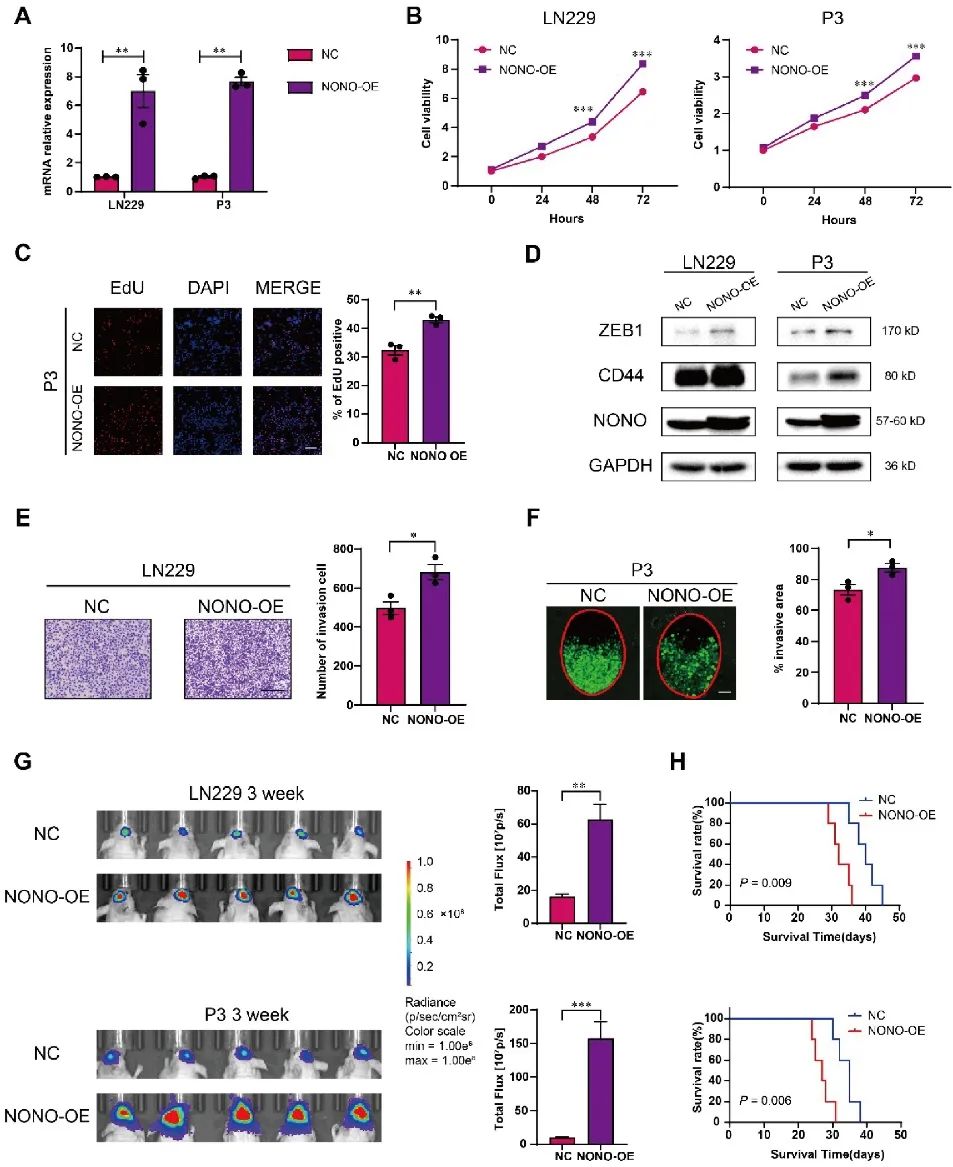
图3 NONO过表达促进GBM的增殖和侵袭
03 剪接因子NONO通过与PSPC1相互作用介导GPX1剪接
为了探索NONO参与GBM发生的机制,研究者对U251和P3-siNONO/NC细胞进行了高通量RNA-seq分析。结果显示,NONO会影响细胞中内含子-外显子连接的整体剪接效率,并在TCGA数据库GBM表达数据中进一步锁定并分析到GPX1和CCN1的表达水平以及剪接效率下降的情况。结果表明,NONO介导了GPX1和CCN1的内含子剪接,影响二者在蛋白水平的表达。NONO的缺失导致GPX1和CCN1基因在mRNA水平显著降低,但pre-mRNA水平保持不变或略有升高。后续结果验证了NONO直接结合pre-mRNA中的内含子来介导GPX1和CCN1的剪接而非成熟的mRNA,并且在细胞核中观察到GPX1的pre-mRNA与NONO的共定位现象。因此,研究者将进一步探索GPX1在NONO下游的功能(图4)。
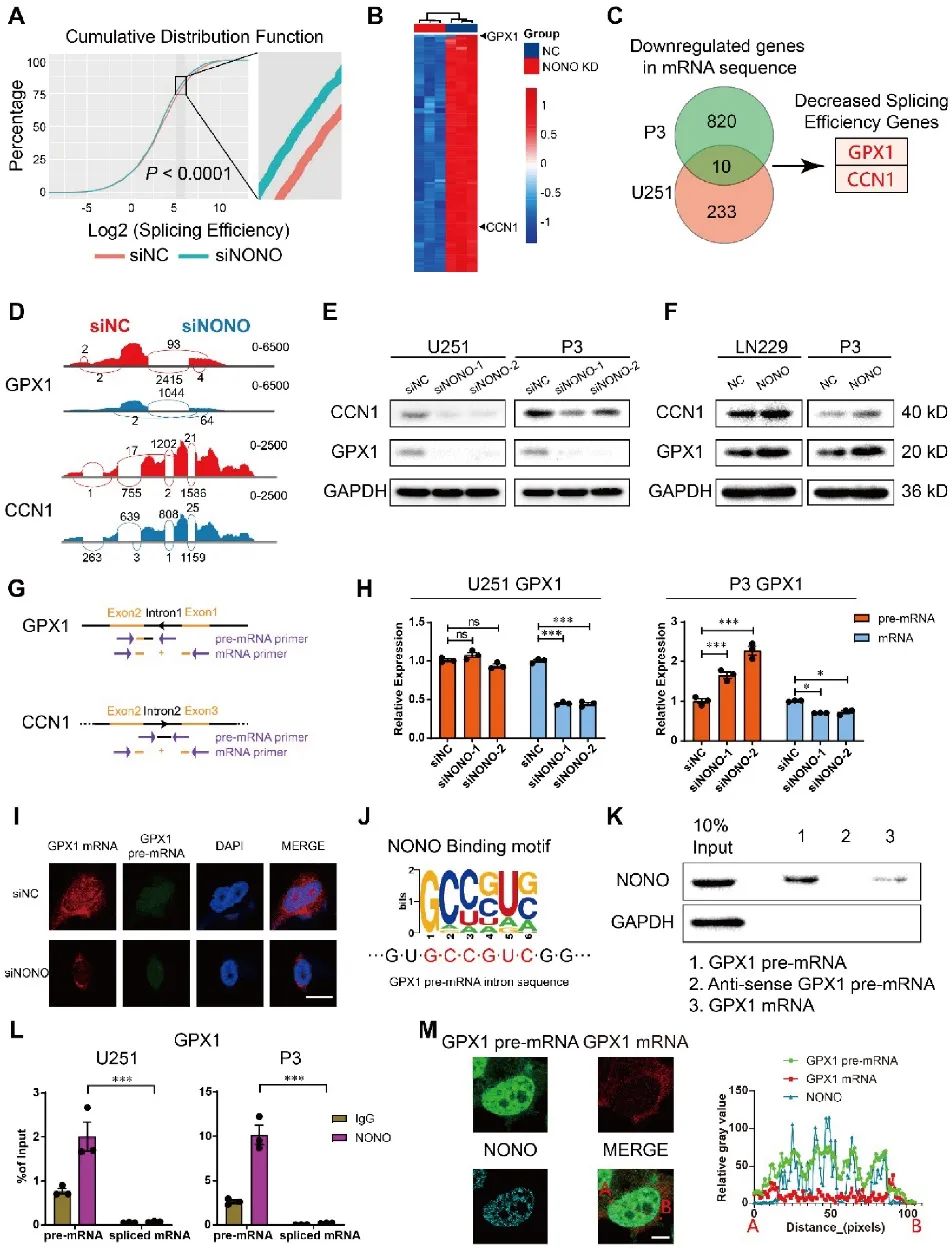
图4 GPX1和CCN1的表达受NONO介导的pre-mRNA剪接调控
GPX1是人体最重要的抗氧化酶之一,可催化过氧化氢与谷胱甘肽反应,维持氧化还原稳态。研究人员基于RNA-seq数据进行了GO富集分析,NONO的敲除与诱导活性氧的反应有关。细胞水平NONO被敲除后,GPX活性被显著抑制、ROS水平增加,氧化还原稳态失衡、线粒体活性降低。挽救实验证明,通过GPX1的过表达可以部分修复GBM细胞系中由于NONO敲除所带来的不良影响(图5)。
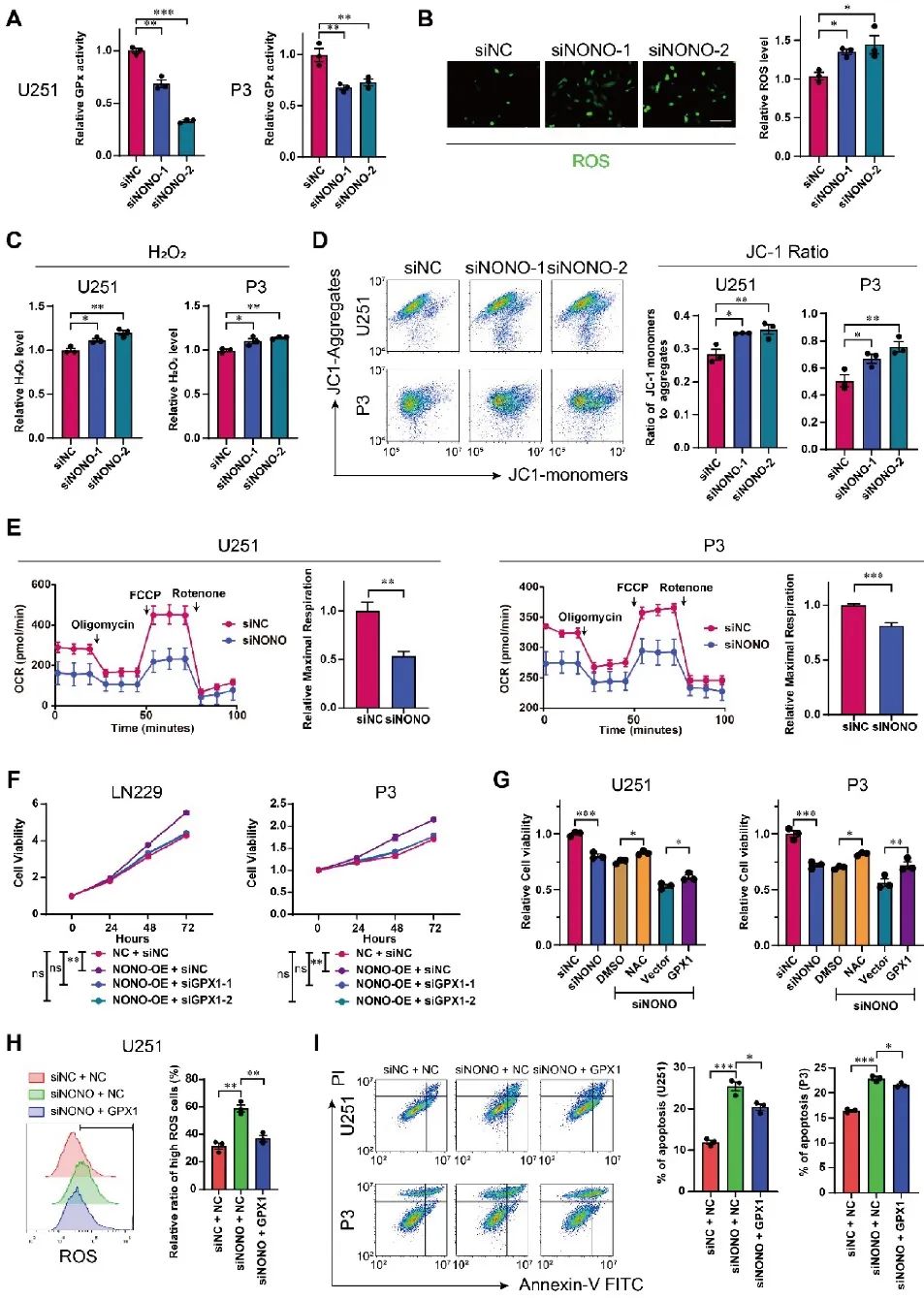
图5 NONO的丢失通过GPX1途径引起氧化还原失衡
随后NONO各结构域在介导GPX1表达过程中的作用引起了研究者的兴趣,首先对NONO蛋白3个结构域(RRM1、RRM2、DBHS)分别进行突变,构建NONO-wt与3个NONO-mut的U251细胞。结果显示只有RRM1-mut对GPX1 mRNA的表达无明显影响,而RRM2-和DBHS-mut的细胞活力显著降低,且RRM2结构域是NONO与pre-mRNA结合所必需的。为了进一步研究DBHS-mut细胞活力降低的原因,通过CoIP分析,最后证实了PSPC1与NONO的DBHS结构域相互作用,并且PSPC1在NONO介导的GPX1剪接过程中是必需的(图6)。
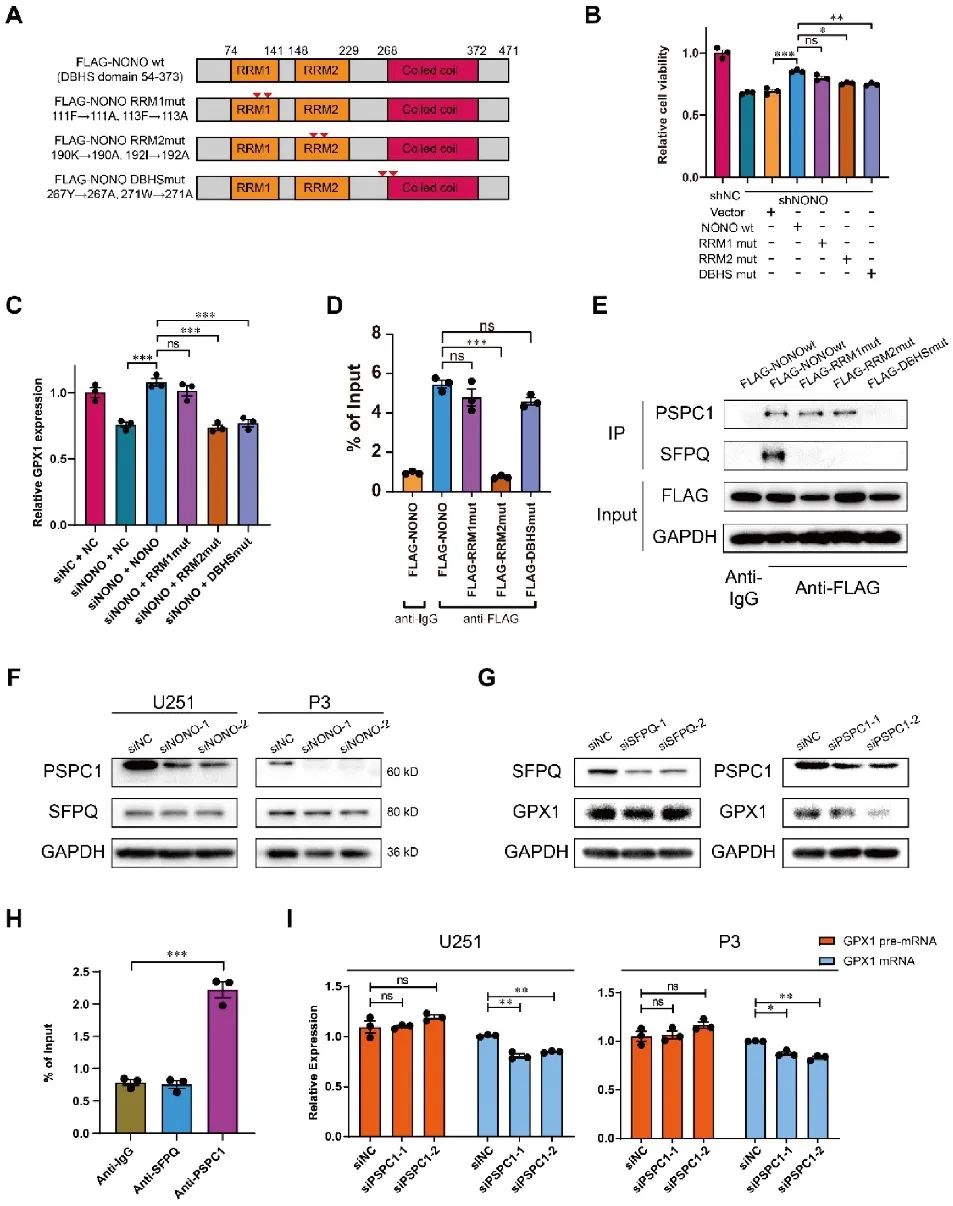
图6 PSPC1协助NONO的RRM2结构域与GPX1 pre-mRNA结合并进行剪接
04 Auranofin,是一种治疗GBM的潜在分子药物
FDA批准的治疗类风湿关节炎的药物Auranofin曾报道具有抗癌活性,也被发现可以抑制GBM中的GPX1。于是,研究者进行了体外SPR分析,发现Auranofin和NONO可以直接结合并且具有较大的亲和力。细胞耐药试验证明Auranofin通过下调NONO和GPX1的转录与表达特异性影响GBM肿瘤细胞活力,且Auranofin对GPX1的抑制是由NONO所介导,促进细胞凋亡,导致线粒体功能下降,并且能够抑制GBM细胞的侵袭。基于体外实验的结果,在裸鼠体内建立P3原位异种移植瘤,Auranofin显著抑制肿瘤生长,延长肿瘤承载动物的生存期。异种移植组织病理结果显示NONO和GPX1表达降低,细胞增殖降低(图7)。
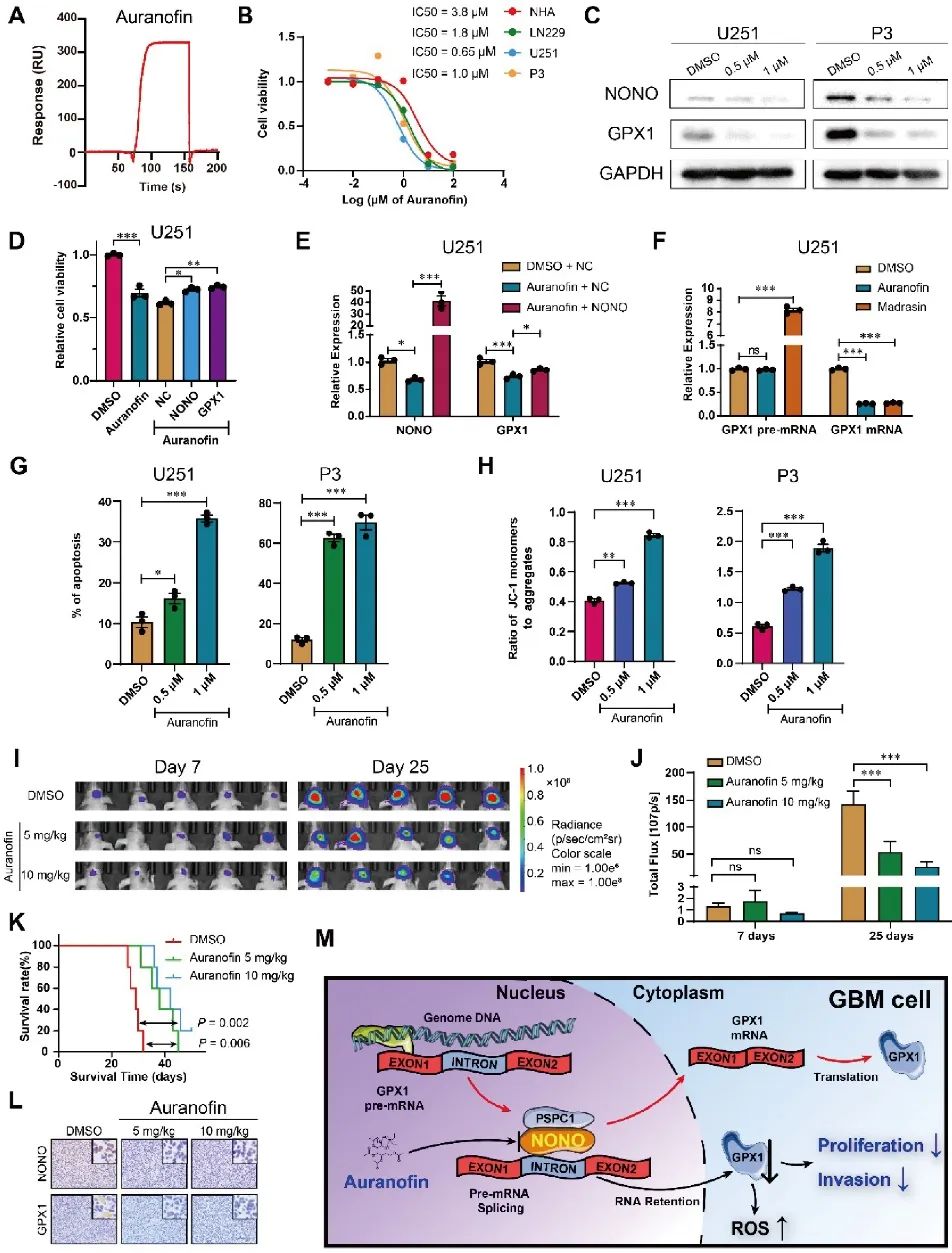
图7 Auranofin通过NONO-GPX1途径抑制GBM
结论
该研究通过对正常细胞系、癌症细胞系以及原代细胞中的NONO等基因进行干扰/过表达(慢病毒)。通过体内体外实验证明了剪接因子NONO的过表达(慢病毒)促进了GBM的进展,而抑制NONO(慢病毒、shRNA)会导致GPX1中内含子的保留,进而导致ROS增加,细胞凋亡和侵袭抑制。此外,Auranofin可能通过靶向NONO介导的GPX1剪接表现出抗癌活性,Auranofin可能成为GBM患者的一种新的治疗药物,成为一种新的治疗策略。
山东大学齐鲁医院李新钢教授、王剑教授和陈安静研究员为本文的共同通讯作者,课题组博士研究生王旭为论文第一作者,山东大学齐鲁医院为第一作者单位和通讯作者单位。
参考文献:
1. Hsu T, Simon L, Neill N, Marcotte R, Sayad A, Bland C, et al. The spliceosome is a therapeutic vulnerability in MYC-driven cancer. Nature. 2015; 525: 384-8.
2. Di C, et al. Function, clinical application, and strategies of Pre-mRNA splicing in cancer. Cell Death Differ. 2019; 26: 1181-94.
3. Monteuuis G, Wong J, Bailey C, Schmitz U, Rasko J. The changing paradigm of intron retention: regulation, ramifications and recipes. Nucleic Acids Res. 2019; 47: 11497-513.
4. Frankiw L, Majumdar D, Burns C, Vlach L, Moradian A, Sweredoski M, et al. BUD13 Promotes a Type I Interferon Response by Countering Intron Retention in Irf7. Mol Cell. 2019; 73: 803-14.e6.
5. Dumbović G, Braunschweig U, Langner H, Smallegan M, Biayna J, Hass E, et al. Nuclear compartmentalization of TERT mRNA and TUG1 lncRNA is driven by intron retention. Nat Commun. 2021; 12: 3308.
6. Ding K, Ji J, Zhang X, Huang B, Chen A, Zhang D, et al. RNA splicing factor USP39 promotes glioma progression by inducing TAZ mRNA maturation. Oncogene. 2019; 38: 6414-28.
7. Gerstberger S, Hafner M, Tuschl T. A census of human RNA-binding proteins. Nat Rev Genet. 2014; 15: 829-45.
8. Qin H, Ni H, Liu Y, Yuan Y, Xi T, Li X, et al. RNA-binding proteins in tumor progression. J Hematol Oncol. 2020; 13: 90.
9. Knott G, Bond C, Fox A. The DBHS proteins SFPQ, NONO and PSPC1: a multipurpose molecular scaffold. Nucleic Acids Res. 2016; 44: 3989-4004.
10. Wang Y, Chen L. Organization and function of paraspeckles. Essays Biochem. 2020; 64: 875-8
