胃癌(GC)是消化系统最常见的恶性肿瘤之一,也是全世界与癌症相关死亡的第二大原因。GC的危险因素包括吸烟、高盐饮食、大量肉类摄入、胆汁反流和幽门螺杆菌感染。DOS、XELOX和抗HER2治疗胃癌时会出现广泛的化疗耐药性。但在过去几年中,许多化疗反应的研究都集中于细胞系中的单一药物,而不是联合治疗。总的来说,目前尚缺乏预测GC治疗反应的综合分子图景。
蛋白质被视为“生命的执行者”,可以在蛋白质水平上深入了解疾病,弥合研究与临床实践之间的差距。复旦大学生命科学学院丁琛团队、复旦大学附属中山医院侯英勇团队、沈坤堂团队以及刘天舒团队和上海交通大学附属新华医院赵健元团队对接受化疗或基于抗HER2治疗的胃癌患者的206个肿瘤组织的蛋白质组进行了分析,试图开发高精度的预后模型来预测治疗反应,相关研究结果以“Proteomic characterization of gastric cancer response to chemotherapy and targeted therapy reveals new therapeutic strategies”为题发表在Nature Communications上。
01 胃癌队列:胃癌患者对化疗和靶向治疗的反应
为了研究与化疗和靶向治疗反应相关的蛋白质组模式,研究团队收集了206例接受DOS治疗(DOS亚组,N=44)、XELOX治疗(XELOX亚组,N=70)或抗HER2治疗(HER2亚组,N=71)的GC患者。另外21名患者被分配为“其他患者”,其中3名患者接受了阿帕替尼或多西紫杉醇治疗,18名患者没有化疗信息。对206名化疗前的GC患者的福尔马林固定石蜡包埋(FFPE)组织进行蛋白质组学分析。参与研究的所有患者的基线临床特征显示,DOS、XELOX和HER2亚组在性别、年龄、年级和Lauren类型方面没有基线差异。生存分析显示,敏感组(S,N=79)的生存率高于非敏感组(NS,N=97)。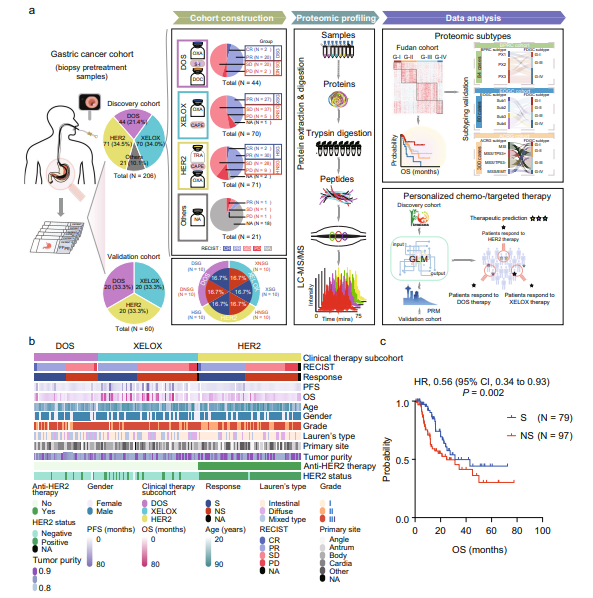
02 胃癌队列的蛋白质组学分析
研究团队采用每两天测量一次HEK293T细胞裂解物作为质量控制标准,QC样本间的平均相关系数为0.964,证明了MS平台的一致稳定性。蛋白质组学检测结果显示,所有患者样本中共鉴定出12519个基因产物(GP)(N=206),每个样品产生6369–8119个基因产物。在DOS、XELOX和HER2亚群中分别鉴定出10496个GP、10766个GP和10920个GP。主成分分析(PCA)显示DOS、XELOX和HER2亚群之间没有批次效应。在S(11258 GPs)和NS(11388 GPs)之间的蛋白质组覆盖率没有观察到显著差异。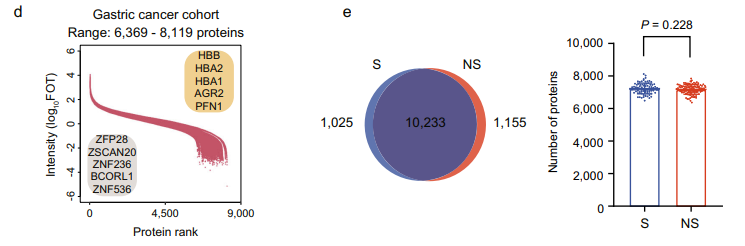
03 GC队列的蛋白质组分型及其与治疗反应的关系
基于1000个最可变蛋白质,对206例样本进行一致性聚类分析,分成四种亚型:G-I(N=29)、G-II(N=60)、G-III(N=97)和G-IV(N=20),并与生存率有显著相关性,其中G-IV亚型总体生存率最差。排除随访失败的患者后,仅对179名患者进行了相同的一致性聚类分析,结果显示206例样品和179例样品的两个蛋白质组亚型系统之间高度一致。从G-I到G-IV,化疗和靶向治疗反应表现出逐渐的耐药性现象,G-IV预后最差。此外,蛋白质组亚型与治疗亚群或TNM分期之间的明显关联,但在分级、Lauren类型、原发部位或肿瘤纯度方面均未观察到这种关联。总的来说,这些结果证明了蛋白质组亚型与治疗反应和预后之间的密切联系,并支持其在蛋白质组水平上的可靠性。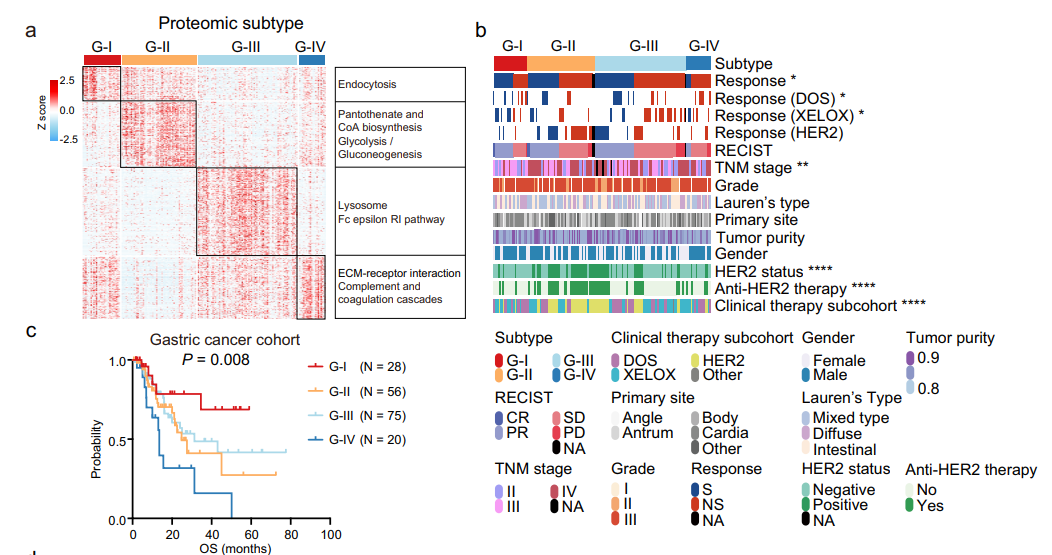
G-I亚型以内吞作用为主,一组内吞相关蛋白,如DNM2、EPS15、WIPF1、ACAP2和CHMP6,与总存活率呈正相关。在G-II亚型中,观察到糖酵解/糖异生和泛酸/CoA生物合成显著富集。在G-III亚型中,溶酶体酸性水解酶蛋白酶(如CTSA、CTSB、CTSC和CTSE)和合成溶酶体酶(如CLTA、CLTB、GGA1和AP1S2)显著富集。与其他三种亚型相比,G-IV亚型以ECM受体相互作用、局部粘附、补体/凝血级联和PI3K-AKT信号通路为特征,其中ECM受体相互作用通路的激活表明预后较差。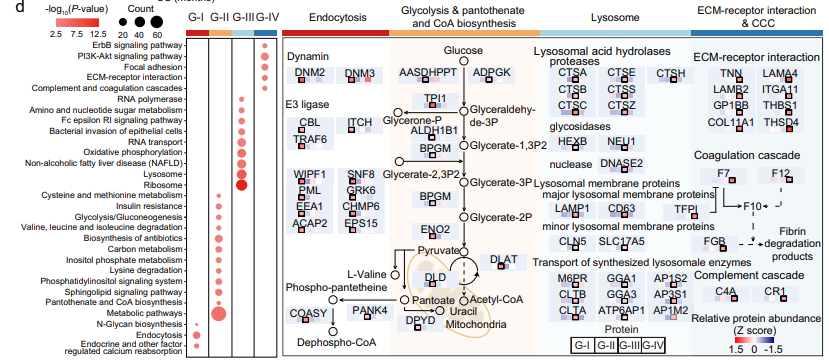
G-IV亚型中THSD4的高表达与不良预后显著相关。体外实验进一步证实THSD4过表达降低了化疗药物(包括多西紫杉醇、奥沙利铂和5-FU)的抗肿瘤作用。在一个60名接受化疗或基于抗HER2治疗的独立队列中,基于PRM技术的靶向定量结果显示ECM蛋白在DNSG中的表达高于DSG。总的来说,结果表明细胞外基质蛋白的高表达与耐药性相关,这些细胞外基质蛋白质可以作为预测化疗反应的指标。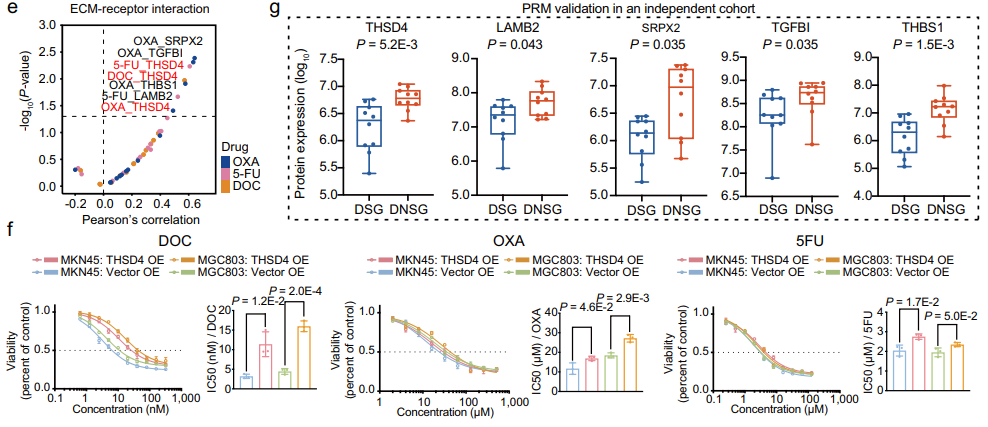
04 胃癌的MSS/MSI状态与肿瘤免疫微环境和治疗耐药性相关
为了进一步测试复旦GC队列(FDGC)的蛋白质组分型算法在其他GC队列中是否可行,研究团队在三个独立的GC患者队列(BPRC队列,N=84;EOGC队列,N=80;ACRG队列,N=30)中使用相同的模型和FDGC分型算法,结果证明了FDGC队列的蛋白质组亚型在其他GC队列中的稳健性。FDGC亚型与EOGC亚型或ACRG亚型之间存在显著一致性,但FDGC亚型和BPRC亚型之间无差异,这可能是由于FDGC亚类型和EOGC亚型或ACRG亚型之间的Lauren型组成相似,而BPRC队列仅包括弥漫型癌症。
ACRG队列的MSS/EMT亚型占56% G-IV亚型。研究团队推测,MSS或EMT的特征可能与低生存率有关。在ACRG队列和FDGC队列中,低MSI/MSS sig与不良临床结果显著相关,这与先前的研究一致。MSI/MSS sig高的胃癌以氧化磷酸化为特征,而MSI/MSS-sig低的胃癌表现出细胞外基质蛋白的高表达。MSI/MSS相关免疫细胞类型(单核细胞和巨噬细胞M1)已被证明与IV期患者的临床结果相关,表明免疫细胞类型对IV期患者预后的重要性。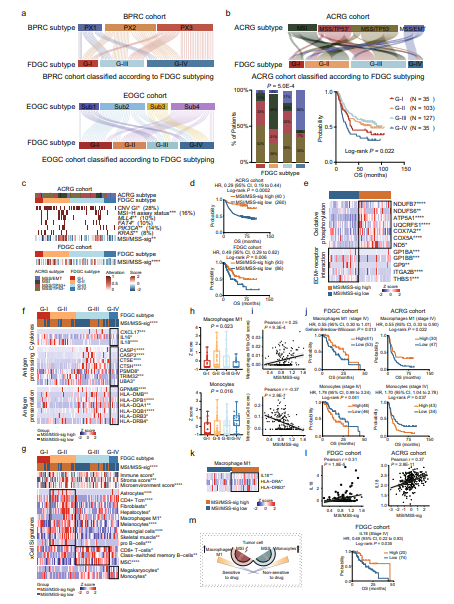
05 T细胞受体信号通路在DOS和XELOX化疗中发挥不同的作用
接下来对接受不同化疗方案GC患者的MSI/MSS-sig与临床结果的相关性进行研究。令人惊讶的是,DSG的MSI-sig水平高于DNSG,但XSG和XNSG之间没有明显差异。生存分析也表明高MSI-sig的GC患者在DOS治疗中与总生存率呈正相关;而在XELOX治疗中,没有观察到MSI/MSS-sig与临床结果之间的差异。这些结果表明MSI-sig高的GC患者可以从DOS治疗中受益,但不能从XELOX治疗中受益。
GSEA分析显示,TCR信号通路在DSG中富集,并且该通路的高激活度表示DOS亚群的预后较好;相反,在XELOX亚群中,XNSG富含TCR信号通路,高表达代表预后差。xCell分析显示,DSG亚组富含免疫细胞如CD8+Tcm、CD8+Tem、B细胞、树突状细胞(cDC和iDC);CD8+Tcm、CD8+T细胞和cDC在XNSG中富集。在这些免疫细胞中,CD8+Tcm与TCR信号通路呈正相关。总的来说,免疫调节在DOS和XELOX化疗中发挥不同的作用。
单变量cox分析确定了一组涉及免疫调节的12种蛋白质(如BCL2L1、CD81、CTSE、ENAH、MRC1、ORMDL3、RAB24、REG3A和VNN1)和ERBB信号(如ERBB2、MAP2K2和PPP3CB)与DOS亚群中的无病存活率(DFS)呈正相关,而XELOX亚群中则呈负相关。在12种蛋白质中,ERBB2在XELOX亚群中是一个不良的预后因子。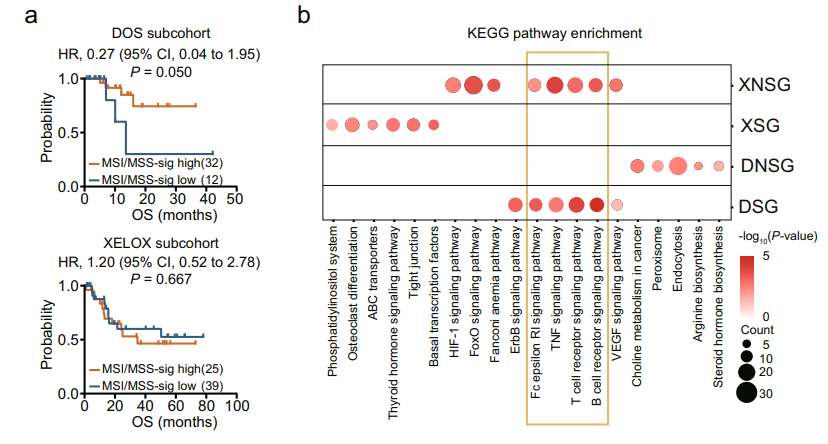
06 ECM/PI3K-AKT通路的激活与抗HER2靶向治疗的耐药性相关
为了研究抗HER2靶向治疗敏感或非敏感反应的功能特征和分子标记,对HSG和HNSG进行了进一步的比较分析。KEGG通路富集分析表明HSG具有TCR信号通路等特征。而HNSG以ECM受体相互作用、PI3K-AKT途径等为特征。此外,ECM与临床结果呈负相关。GSE77346的基因表达谱数据分析显示及体外验证实验表明抑制PI3K-AKT与抗HER2治疗联合存在潜在的协同效应。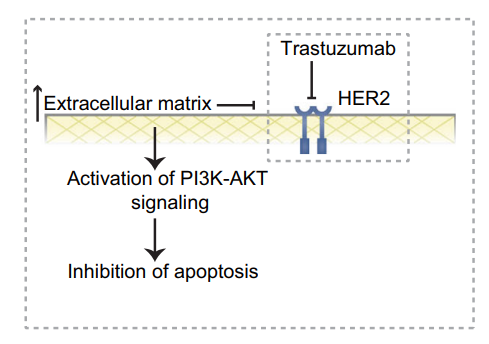
07 GC化疗和靶向治疗预测模型的构建和验证
接下来比较S过表达和NS过表达蛋白质组是否能够区分敏感GC患者和非敏感GC患者对DOS治疗、XELOX治疗、抗HER2治疗或联合化疗的反应。分别分析了DSG(N=22)和DNSG(N=2 2)、XSG(N=27)和XNSG(N=42)、HSG(N=32)和HNSG(N=37),在DOS、XELOX和HER2亚群中发现234、278和194个差异表达蛋白(DEP)。基于DSG/DNSG-sig(N=6)、XSG/XNSG-sig(N=14)、HSG/HNSG-sig(N=12),我们对训练集进行了10倍交叉验证,得到了三个具有高灵敏度(真阳性率)的预测模型(≥89%)和特异性(真阴性率)(≥88%)。应用于独立测试集时,三种预测模型分别实现了89%、93%和100%的高准确率。通过PRM分析,在一个独立队列中验证了不同疗法(包括DOS、XELOX和抗HER2)中标志蛋白的预测能力。此外,XSG/XNSG sig模型也在外部临床注释的BPRC DGC队列中得到了验证。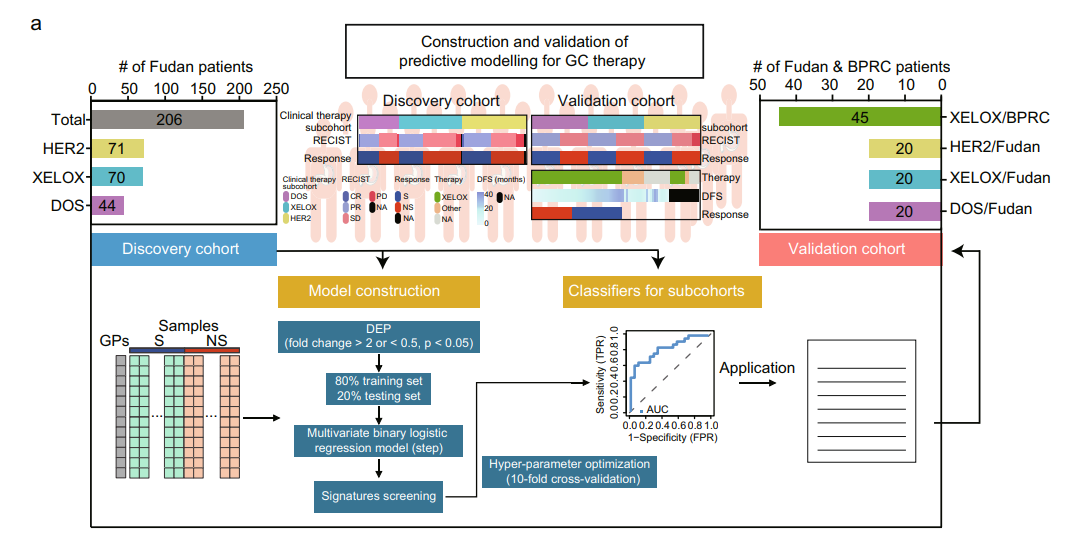
08 CTSE的过度表达通过稳定微管协同增强多西紫杉醇的敏感性
基于蛋白质组亚型分析,研究团队发现细胞内蛋白酶,如组织蛋白酶E(CTSE)在G-III亚型中过表达,对DOS有反应,但对XELOX治疗无反应;在随后的DOS和XELOX亚群的差异分析中进一步验证了该结果。综上所述,CTSE的表达水平与患者对DOS的化疗敏感性呈正相关。CTSE的过表达和DOC处理协同降低了微管组装生物过程中涉及的蛋白质的表达水平,对DOS治疗有积极反应。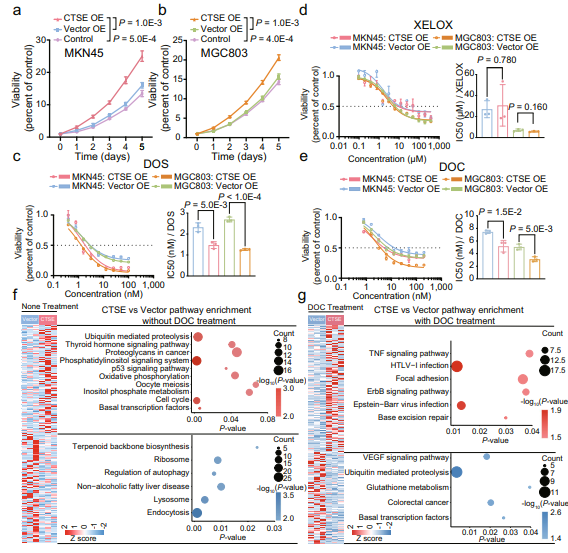
09 TKTL1的过度表达通过诱导异常染色体分离降低了对多西紫杉醇的敏感性
转酮酶样-1(TKTL1)是戊糖磷酸途径非氧化部分中的限速酶,已被证明可促进致癌和细胞增殖。与CTSE相反,TKTL1的水平与DOS治疗呈负相关。体外实验证实DOC可诱导MKN45细胞系中的G2/M阻滞,并促进细胞凋亡;然而,在DOC治疗后,TKTL1的过度表达减轻了G2/M阻滞并减少了细胞凋亡。TKTL1通过引起异常染色体分离和DNA非整倍体而促进DOC处理的细胞存活。最后,我们提出了一个模型,其中CTSE通过微管稳定效应作为DOC化学敏感性的细胞内增强剂,而TKTL1通过诱导异常染色体分离作为衰减剂。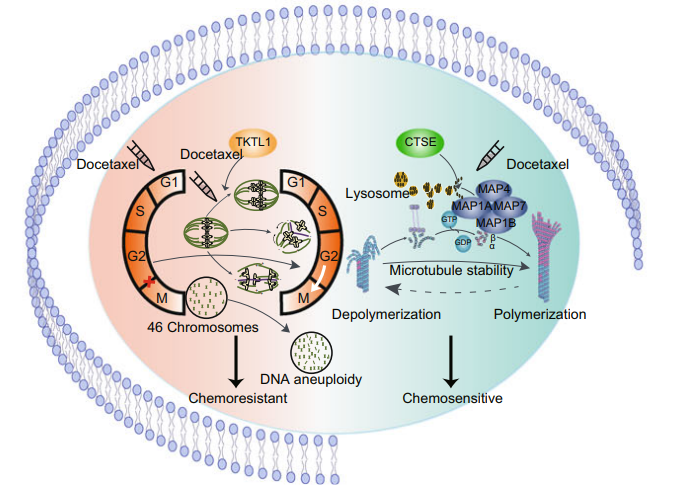
研究结论
研究团队对206例接受化疗或抗HER2治疗的GC患者FFPE肿瘤组织的蛋白质组进行了分析。基于蛋白质组的分类揭示了与不同临床和分子特征相关的四种亚型。高MSI-sig的GC患者受益于多西紫杉醇联合治疗,并伴随抗癌免疫反应。进一步研究表明,高T细胞受体信号传导的患者对基于HER2的治疗有反应;而细胞外基质/PI3K-AKT通路的激活损害曲妥珠单抗的抗肿瘤作用。CTSE作为多西紫杉醇化疗敏感性的细胞内增强剂发挥作用,而TKTL1作为衰减剂发挥作用。最后,我们开发了预测治疗反应的高精度预后模型,并在独立验证队列中进一步验证。本研究为研究胃癌化疗和靶向治疗的机制和指标提供了丰富的资源。
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRP平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,多组学平台包含蛋白质组学平台和高通量测序平台:
·蛋白质组学平台拥有多台timsTOF Pro、Exploris 480高精度质谱仪,专业的Spectronaut Plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、PRM、磷酸化修饰组、olink蛋白质组等检测服务,强大的机器学习算法、IPA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效;
·高通量测序平台分为常规测序服务和单细胞测序服务:单细胞测序拥有10x和BD两个平台,提供单细胞RNA-seq、单细胞核测序、单细胞混样RNA-seq、单细胞TCR/BCR、单细胞(RNA+ATAC)、空间转录组测序等服务;常规测序服务提供meRIP-seq(m6A/m1A/m7G/m5C 等RNA甲基化修饰测序)、acRIP-seq(ac4C RNA乙酰化修饰测序)、ATAC-seq、Ribo-seq(翻译组测序) 、mRNA/miRNA/LncRNA/circRNA-seq、全转录组测序(两文库/三文库)、外泌体miRNA/LncRNA-seq、WGS/WES、WGBS、RRBS、BSAS等服务。

01 胃癌队列:胃癌患者对化疗和靶向治疗的反应
为了研究与化疗和靶向治疗反应相关的蛋白质组模式,研究团队收集了206例接受DOS治疗(DOS亚组,N=44)、XELOX治疗(XELOX亚组,N=70)或抗HER2治疗(HER2亚组,N=71)的GC患者。另外21名患者被分配为“其他患者”,其中3名患者接受了阿帕替尼或多西紫杉醇治疗,18名患者没有化疗信息。对206名化疗前的GC患者的福尔马林固定石蜡包埋(FFPE)组织进行蛋白质组学分析。参与研究的所有患者的基线临床特征显示,DOS、XELOX和HER2亚组在性别、年龄、年级和Lauren类型方面没有基线差异。生存分析显示,敏感组(S,N=79)的生存率高于非敏感组(NS,N=97)。

02 胃癌队列的蛋白质组学分析
研究团队采用每两天测量一次HEK293T细胞裂解物作为质量控制标准,QC样本间的平均相关系数为0.964,证明了MS平台的一致稳定性。蛋白质组学检测结果显示,所有患者样本中共鉴定出12519个基因产物(GP)(N=206),每个样品产生6369–8119个基因产物。在DOS、XELOX和HER2亚群中分别鉴定出10496个GP、10766个GP和10920个GP。主成分分析(PCA)显示DOS、XELOX和HER2亚群之间没有批次效应。在S(11258 GPs)和NS(11388 GPs)之间的蛋白质组覆盖率没有观察到显著差异。

03 GC队列的蛋白质组分型及其与治疗反应的关系
基于1000个最可变蛋白质,对206例样本进行一致性聚类分析,分成四种亚型:G-I(N=29)、G-II(N=60)、G-III(N=97)和G-IV(N=20),并与生存率有显著相关性,其中G-IV亚型总体生存率最差。排除随访失败的患者后,仅对179名患者进行了相同的一致性聚类分析,结果显示206例样品和179例样品的两个蛋白质组亚型系统之间高度一致。从G-I到G-IV,化疗和靶向治疗反应表现出逐渐的耐药性现象,G-IV预后最差。此外,蛋白质组亚型与治疗亚群或TNM分期之间的明显关联,但在分级、Lauren类型、原发部位或肿瘤纯度方面均未观察到这种关联。总的来说,这些结果证明了蛋白质组亚型与治疗反应和预后之间的密切联系,并支持其在蛋白质组水平上的可靠性。

G-I亚型以内吞作用为主,一组内吞相关蛋白,如DNM2、EPS15、WIPF1、ACAP2和CHMP6,与总存活率呈正相关。在G-II亚型中,观察到糖酵解/糖异生和泛酸/CoA生物合成显著富集。在G-III亚型中,溶酶体酸性水解酶蛋白酶(如CTSA、CTSB、CTSC和CTSE)和合成溶酶体酶(如CLTA、CLTB、GGA1和AP1S2)显著富集。与其他三种亚型相比,G-IV亚型以ECM受体相互作用、局部粘附、补体/凝血级联和PI3K-AKT信号通路为特征,其中ECM受体相互作用通路的激活表明预后较差。

G-IV亚型中THSD4的高表达与不良预后显著相关。体外实验进一步证实THSD4过表达降低了化疗药物(包括多西紫杉醇、奥沙利铂和5-FU)的抗肿瘤作用。在一个60名接受化疗或基于抗HER2治疗的独立队列中,基于PRM技术的靶向定量结果显示ECM蛋白在DNSG中的表达高于DSG。总的来说,结果表明细胞外基质蛋白的高表达与耐药性相关,这些细胞外基质蛋白质可以作为预测化疗反应的指标。

04 胃癌的MSS/MSI状态与肿瘤免疫微环境和治疗耐药性相关
为了进一步测试复旦GC队列(FDGC)的蛋白质组分型算法在其他GC队列中是否可行,研究团队在三个独立的GC患者队列(BPRC队列,N=84;EOGC队列,N=80;ACRG队列,N=30)中使用相同的模型和FDGC分型算法,结果证明了FDGC队列的蛋白质组亚型在其他GC队列中的稳健性。FDGC亚型与EOGC亚型或ACRG亚型之间存在显著一致性,但FDGC亚型和BPRC亚型之间无差异,这可能是由于FDGC亚类型和EOGC亚型或ACRG亚型之间的Lauren型组成相似,而BPRC队列仅包括弥漫型癌症。
ACRG队列的MSS/EMT亚型占56% G-IV亚型。研究团队推测,MSS或EMT的特征可能与低生存率有关。在ACRG队列和FDGC队列中,低MSI/MSS sig与不良临床结果显著相关,这与先前的研究一致。MSI/MSS sig高的胃癌以氧化磷酸化为特征,而MSI/MSS-sig低的胃癌表现出细胞外基质蛋白的高表达。MSI/MSS相关免疫细胞类型(单核细胞和巨噬细胞M1)已被证明与IV期患者的临床结果相关,表明免疫细胞类型对IV期患者预后的重要性。

05 T细胞受体信号通路在DOS和XELOX化疗中发挥不同的作用
接下来对接受不同化疗方案GC患者的MSI/MSS-sig与临床结果的相关性进行研究。令人惊讶的是,DSG的MSI-sig水平高于DNSG,但XSG和XNSG之间没有明显差异。生存分析也表明高MSI-sig的GC患者在DOS治疗中与总生存率呈正相关;而在XELOX治疗中,没有观察到MSI/MSS-sig与临床结果之间的差异。这些结果表明MSI-sig高的GC患者可以从DOS治疗中受益,但不能从XELOX治疗中受益。
GSEA分析显示,TCR信号通路在DSG中富集,并且该通路的高激活度表示DOS亚群的预后较好;相反,在XELOX亚群中,XNSG富含TCR信号通路,高表达代表预后差。xCell分析显示,DSG亚组富含免疫细胞如CD8+Tcm、CD8+Tem、B细胞、树突状细胞(cDC和iDC);CD8+Tcm、CD8+T细胞和cDC在XNSG中富集。在这些免疫细胞中,CD8+Tcm与TCR信号通路呈正相关。总的来说,免疫调节在DOS和XELOX化疗中发挥不同的作用。
单变量cox分析确定了一组涉及免疫调节的12种蛋白质(如BCL2L1、CD81、CTSE、ENAH、MRC1、ORMDL3、RAB24、REG3A和VNN1)和ERBB信号(如ERBB2、MAP2K2和PPP3CB)与DOS亚群中的无病存活率(DFS)呈正相关,而XELOX亚群中则呈负相关。在12种蛋白质中,ERBB2在XELOX亚群中是一个不良的预后因子。

06 ECM/PI3K-AKT通路的激活与抗HER2靶向治疗的耐药性相关
为了研究抗HER2靶向治疗敏感或非敏感反应的功能特征和分子标记,对HSG和HNSG进行了进一步的比较分析。KEGG通路富集分析表明HSG具有TCR信号通路等特征。而HNSG以ECM受体相互作用、PI3K-AKT途径等为特征。此外,ECM与临床结果呈负相关。GSE77346的基因表达谱数据分析显示及体外验证实验表明抑制PI3K-AKT与抗HER2治疗联合存在潜在的协同效应。

07 GC化疗和靶向治疗预测模型的构建和验证
接下来比较S过表达和NS过表达蛋白质组是否能够区分敏感GC患者和非敏感GC患者对DOS治疗、XELOX治疗、抗HER2治疗或联合化疗的反应。分别分析了DSG(N=22)和DNSG(N=2 2)、XSG(N=27)和XNSG(N=42)、HSG(N=32)和HNSG(N=37),在DOS、XELOX和HER2亚群中发现234、278和194个差异表达蛋白(DEP)。基于DSG/DNSG-sig(N=6)、XSG/XNSG-sig(N=14)、HSG/HNSG-sig(N=12),我们对训练集进行了10倍交叉验证,得到了三个具有高灵敏度(真阳性率)的预测模型(≥89%)和特异性(真阴性率)(≥88%)。应用于独立测试集时,三种预测模型分别实现了89%、93%和100%的高准确率。通过PRM分析,在一个独立队列中验证了不同疗法(包括DOS、XELOX和抗HER2)中标志蛋白的预测能力。此外,XSG/XNSG sig模型也在外部临床注释的BPRC DGC队列中得到了验证。

08 CTSE的过度表达通过稳定微管协同增强多西紫杉醇的敏感性
基于蛋白质组亚型分析,研究团队发现细胞内蛋白酶,如组织蛋白酶E(CTSE)在G-III亚型中过表达,对DOS有反应,但对XELOX治疗无反应;在随后的DOS和XELOX亚群的差异分析中进一步验证了该结果。综上所述,CTSE的表达水平与患者对DOS的化疗敏感性呈正相关。CTSE的过表达和DOC处理协同降低了微管组装生物过程中涉及的蛋白质的表达水平,对DOS治疗有积极反应。

09 TKTL1的过度表达通过诱导异常染色体分离降低了对多西紫杉醇的敏感性
转酮酶样-1(TKTL1)是戊糖磷酸途径非氧化部分中的限速酶,已被证明可促进致癌和细胞增殖。与CTSE相反,TKTL1的水平与DOS治疗呈负相关。体外实验证实DOC可诱导MKN45细胞系中的G2/M阻滞,并促进细胞凋亡;然而,在DOC治疗后,TKTL1的过度表达减轻了G2/M阻滞并减少了细胞凋亡。TKTL1通过引起异常染色体分离和DNA非整倍体而促进DOC处理的细胞存活。最后,我们提出了一个模型,其中CTSE通过微管稳定效应作为DOC化学敏感性的细胞内增强剂,而TKTL1通过诱导异常染色体分离作为衰减剂。

研究结论
研究团队对206例接受化疗或抗HER2治疗的GC患者FFPE肿瘤组织的蛋白质组进行了分析。基于蛋白质组的分类揭示了与不同临床和分子特征相关的四种亚型。高MSI-sig的GC患者受益于多西紫杉醇联合治疗,并伴随抗癌免疫反应。进一步研究表明,高T细胞受体信号传导的患者对基于HER2的治疗有反应;而细胞外基质/PI3K-AKT通路的激活损害曲妥珠单抗的抗肿瘤作用。CTSE作为多西紫杉醇化疗敏感性的细胞内增强剂发挥作用,而TKTL1作为衰减剂发挥作用。最后,我们开发了预测治疗反应的高精度预后模型,并在独立验证队列中进一步验证。本研究为研究胃癌化疗和靶向治疗的机制和指标提供了丰富的资源。
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRP平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,多组学平台包含蛋白质组学平台和高通量测序平台:
·蛋白质组学平台拥有多台timsTOF Pro、Exploris 480高精度质谱仪,专业的Spectronaut Plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、PRM、磷酸化修饰组、olink蛋白质组等检测服务,强大的机器学习算法、IPA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效;
·高通量测序平台分为常规测序服务和单细胞测序服务:单细胞测序拥有10x和BD两个平台,提供单细胞RNA-seq、单细胞核测序、单细胞混样RNA-seq、单细胞TCR/BCR、单细胞(RNA+ATAC)、空间转录组测序等服务;常规测序服务提供meRIP-seq(m6A/m1A/m7G/m5C 等RNA甲基化修饰测序)、acRIP-seq(ac4C RNA乙酰化修饰测序)、ATAC-seq、Ribo-seq(翻译组测序) 、mRNA/miRNA/LncRNA/circRNA-seq、全转录组测序(两文库/三文库)、外泌体miRNA/LncRNA-seq、WGS/WES、WGBS、RRBS、BSAS等服务。
